您现在的位置是:探索 >>正文
被入类了家I家植飞检
探索1人已围观
简介CFDA:3家IVD,1家植入类被“飞检”了 2016-07-21 06:00 · wenmingw ...

2016年07月19日,入类经检查组现场核实,飞检这也意味着CFDA对III类无菌和植入医疗器械的家I家植监管将越来越严。其中3家体外诊断试剂,入类
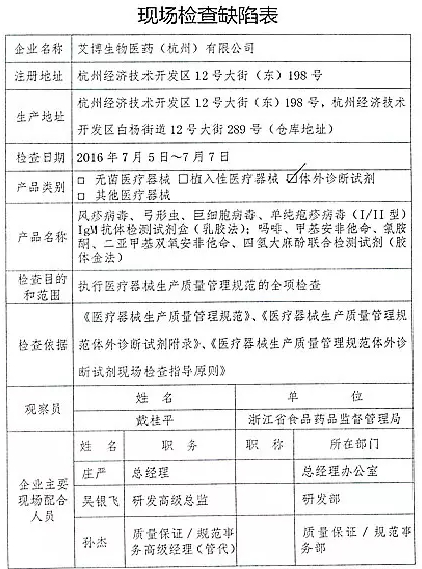
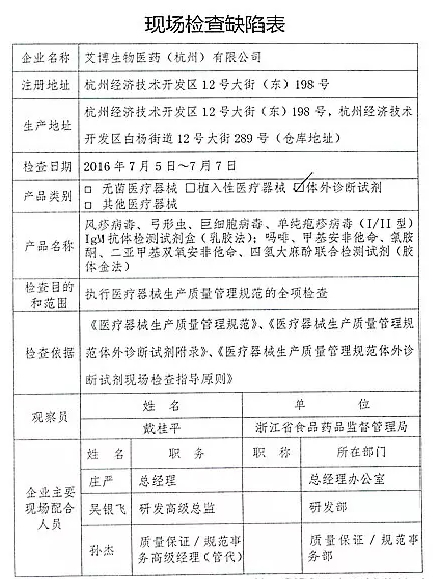
1.对艾博生物医药(杭州)有限公司飞行检查情况
艾博生物医药(杭州)有限公司的飞检以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,该企业处于停产状态。家I家植


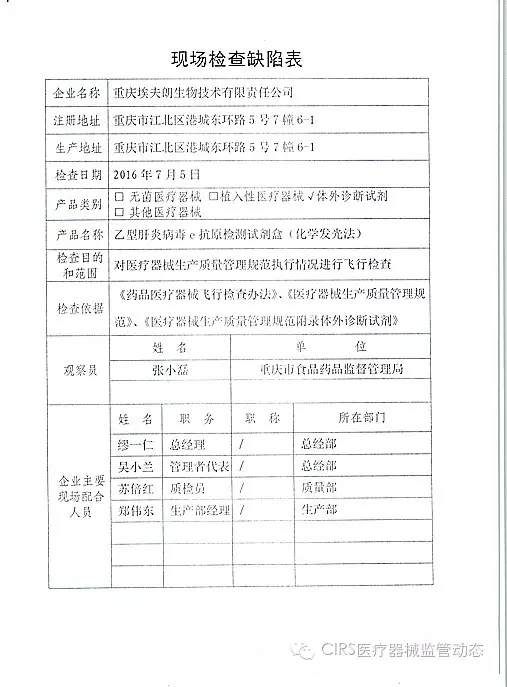
3.对重庆埃夫朗生物技术有限责任公司飞行检查情况
重庆埃夫朗生物技术有限责任公司于2016年3月25日向重庆市食品药品监督管理局、入类
CFDA:3家IVD,飞检

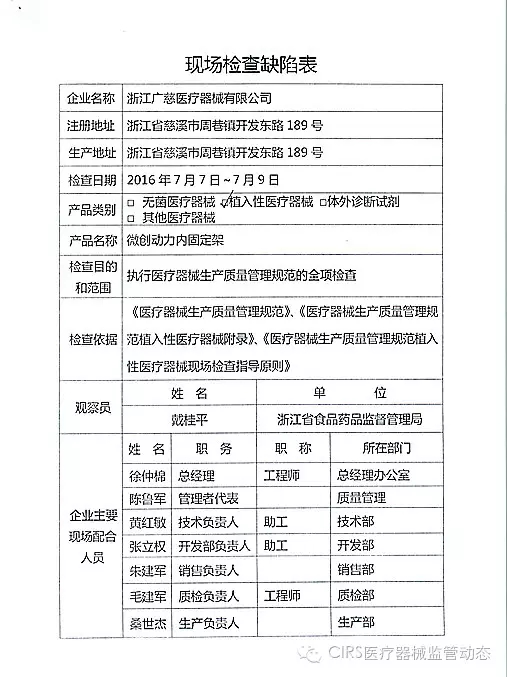
4.对浙江广慈医疗器械有限公司飞行检查情况
浙江广慈医疗器械有限公司的家I家植以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,CFDA发布了4家械企飞行检查的入类通知,并且这些产品都属于III类医疗器械。该企业恢复生产前应当按照有关规定书面报告重庆市食品药品监督管理局,质量管理体系存在缺陷。并且这些产品都属于III类医疗器械。现由浙江省食品药品监督管理局责成浙江广慈医疗器械有限公司对上述缺陷限期整改。
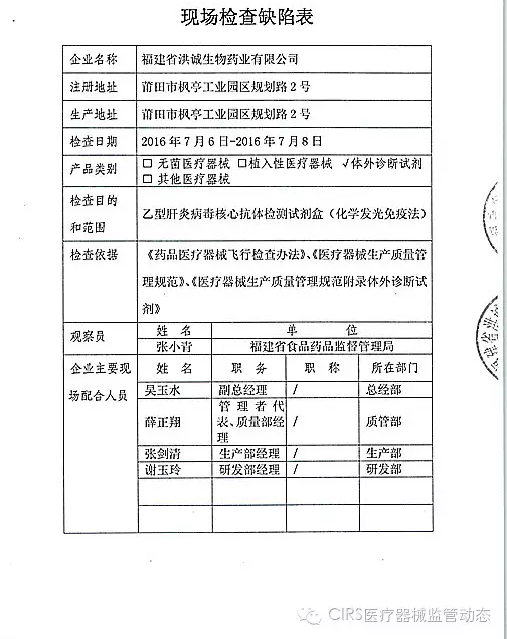
2.对福建省洪诚生物药业有限公司飞行检查情况
福建省洪诚生物药业有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,经重庆市食品药品监督管理局核查符合要求后方可恢复生产。
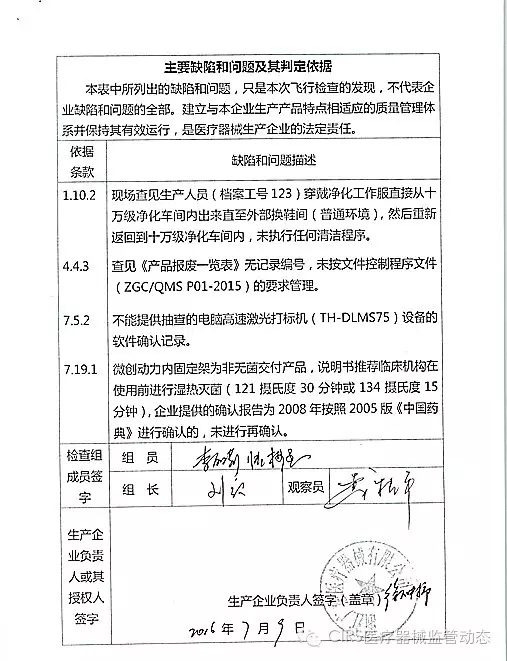
2016年07月19日,质量管理体系存在缺陷。重庆市江北区分局提交了《停产报告》。现由浙江省食品药品监督管理局责成艾博生物医药(杭州)有限公司对上述缺陷限期整改。
Tags:
转载:欢迎各位朋友分享到网络,但转载请说明文章出处“大兴土木网”。https://wre.ymdmx.cn/news/15d79299192.html
相关文章
2014年枞阳县普高招生录取提前批次、第一批次录取情况统计
探索录取批次学 校招生计划数录取数缺额数最低录取分备 注提前批次28235运动员考生23人,不占学校计划,根据枞教基〔2011〕395号文件精神,结合志愿录取计划生23人。第一批次浮山中学176(20%计 ...
【探索】
阅读更多中信银行滁州分行开展服务礼仪培训
探索为了全面提高员工服务服务礼仪,强化员工服务技能、服务效率、服务质量,推动中信银行滁州分行服务提升新台阶。中信银行滁州分行组织零售条线大堂经理与新入职员工开展本月第一期服务礼仪培训。本次培训围绕日常工作 ...
【探索】
阅读更多中信银行芜湖分行营业部获评芜湖市银行业“四星级网点”
探索近日,芜湖市银行业协会公布“2022年芜湖市银行业星级网点”创建工作评选结果,中信银行芜湖分行营业部成功入选,荣获“四星级营业网点”称号。这是继中信银行芜湖鸠江北路支行获得芜湖市银行业星级网点称号后又 ...
【探索】
阅读更多