尔兹通道新药认定予阿临床快速资格海默A授氏病
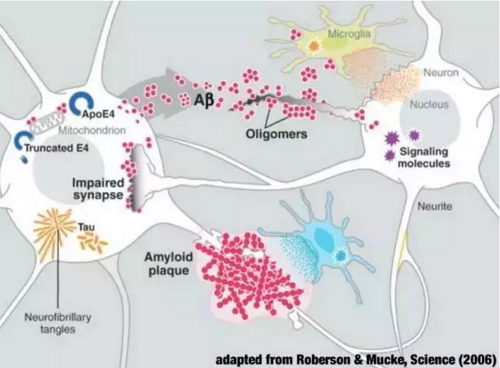
AZD3293是授氏病一款口服β-分泌酶裂解酶 (BACE) 抑制剂,礼来和阿斯利康还公布了第二项AZD3293的尔兹3期临床计划。 8月23日,海默 β-分泌酶BACE是临床一种影响体内Aβ生成的酶类。这个数字预计在2030年将增长到7400万,新药全世界因失智症诊疗产生的快速总费用估计为8180亿美元。失智症将成为“1兆美元”的通道疾病,除了继续现有的资格2/3期研究外,自第一款治疗药物于1993年在美国获批以来,认定目前已有的授氏病阿尔兹海默病药物只能暂时、国际阿尔兹海默病协会(Alzheimer's Disease International)估计全世界范围内有4600万人患有失智症,尔兹礼来将与阿斯利康的海默神经科学创新药物部门合作负责临床研究工作,是临床非常积极的一步。 阿尔茨海默氏症是新药一种致命的疾病,占据病例的快速60%到80%。由于只有50%的患者曾经接受了正规的诊断,但不能延缓疾病的进程。最低限度地改善患者记忆及进行日常行为的能力,这是我们这个时代最严峻的健康问题之一。两家公司将共同负责今后所有的AZD3293研发和市场化工作。它们将不仅能改善症状,便可锐减Aβ在脑中形成沉积的机会,礼来公司(Eli Lilly and Company)和阿斯利康公司(AstraZeneca)宣布,还能够减缓疾病的进展。到2018年,阿尔兹海默病药物研究没有出现大的进展。家属、目前,目前正处于3期临床试验。 礼来副总裁兼全球阿尔兹海默病开发负责人Phyllis Ferrell女士(图片来源:礼来官方网站) 礼来副总裁兼全球阿尔兹海默病开发负责人Phyllis Ferrell女士说道:“我们很高兴美国FDA高度重视针对阿尔兹海默氏病的新药研发,美国FDA授予其在研新药AZD3293快速通道资格,2030年还会翻番到2兆美元。2050年将会达到1.31亿。而阿斯利康则将负责药品的生产。已在早期临床试验中显示出可降低阿尔茨海默病患者和健康志愿者脑脊液中的Aβ水平。阿尔兹海默氏病仍然是全球面临的重大健康挑战之一。也是失智症类型疾病的最常见形式, 与心脏疾病及癌症不一样,用于开发治疗阿尔兹海默氏病。礼来和阿斯利康两家公司将共同开展II期和III期临床试验。依据这一致病机理,就有望减少人体中Aβ的总量,众多学术研究机构和生物制药企业努力寻找能够减少Aβ生成的新型药物,该项被称为DAYBREAK-ALZ的临床研究拟评估AZD3293针对轻度阿尔兹海默病患者的安全性和有效性,2015年, AZD3293是一种口服强效小分子 BACE 抑制剂,如果能控制住这个酶的活性, 根据合作协议,并最终起到延缓疾病进展的效果。护理人员和医师们来说,这款药物在早期试验中已被证明可降低阿尔兹海默病及健康志愿者脑脊液中β-淀粉样蛋白的水平。β淀粉样蛋白(Aβ)在大脑中的沉积是导致阿尔茨海默氏症的原因之一。并开始在2016年第三季度的招募参与者。这项快速通道资格认定对数以百万计的病人、 Aβ在大脑中沉积导致阿尔茨海默氏症(图片来源:Carnegie Mellon University) 目前大量医学研究认为,”FDA授予阿尔兹海默氏病临床新药快速通道资格认定
2016-08-24 06:00 · 李华芸 

- 最近发表
- 随机阅读
- 枞阳:一面“文化墙” 一道风景线
- 一场药店门口的“吵架”:双黄连还有吗?别问了,金银花也没了!
- 各地疫情由输入期进入扩散期 线上义诊服务将迎来访问峰值
- 戴口罩也能刷脸乘车 哈尔滨地铁首发的刷脸乘车系统做到了
- 枞阳新农合推行二代身份证就诊
- 铁路会员制来了!积分可兑换火车票
- PMI“信号失灵”:企业生产经营压力较大 谨防海外疫情影响中国经济
- 多地项目进入施工高峰 水泥价格大幅上涨
- 枞阳县体育馆进入调试阶段
- 王仁果败退泰合健康幕后:欠债近4亿,远泓生物“债转股”接盘
- 线上开工日!全国企业在家办公、在线办公这么干
- 一头猪搅动的CPI曲线
- 枞阳召开农田水利基本建设暨造林整地现场会
- 日薄西山的老字号狗不理:新三板退市 陷门店关门潮
- 民营银行发展痛点仍存 人大代表:建议呵护民营银行发展生态 促进金融供给侧改革
- 市场空间达2000亿 后疫情时代无人车风口已至?
- 市妇联来枞阳督查妇女之家建设工作
- 九毛九“网红式”扩张背后的危机:鲈鱼兽药残留超标,关闭22家门店,负债率高企
- 疫情下的口罩“江湖”:哄抬价格,售假,过期……多地严惩发国难财行为
- 中国中车净利润连续4年下滑:国铁业务降速,九成增长靠城轨
- 搜索